A la tercera repetición de la cadena de síntesis hematopoyética, caí en la cuenta de cuán grande es el potencial de las células madre o stem cells. Por esto y por las repetidas alusiones a las infiltraciones de los más famosos deportistas tan normales a día de hoy, decidí leer un poco más sobre ellas.
Las células madre se definen como células con capacidad de división ilimitada, diferentes umbrales de pluripotencia con división asimétrica (autorrenovación y diferenciación). Son imprescindibles en la embriogénesis, en los tejidos regenerativos y ahora en aplicaciones clínicas.
En individuos adultos también existen fuentes de células madre como son la piel, el intestino, la médula y una región encefálica determinada. Además podemos desdiferenciar células ya especializadas por reprogramación nuclear que consiste en incluir el núcleo de la célula somática en el oocito enucleado por técnicas de biología molecular.
Un grupo coreano (Yong Ho Park et al.) ha conseguido recientemente células stem mesenquimales derivadas de membrana amniótica humana, capaces de diferenciarse en otros tipos celulares y tener propiedades inmunomoduladoras entrando en el juego de la señalización celular factores como TGF beta, PGE2 o HGF. En este proyecto demuestran que dichas células son capaces de inhibir la proliferación de PBMCs (células mononucleares de sangre periférica) cuando son co-cultivadas o cuando se las añade el sobrenadante del cultivo de las células mesenquimales, con lo que se evidencia la intervención de factores solubles de señalización.
Estas células pluripotentes mesenquimales ya han sido empleadas en terapia, como por ejemplo en la regeneración de los discos intervertebrales. Esta degeneración es debida a la reducción en la síntesis de componentes de la matriz extracelular específica de cartílago. Se ha demostrado su capacidad de diferenciación a células del núcleo pulposo y a condrocitos, pero tienen limitaciones in vivo dado que el microambiente del disco intervertebral es extremo en cuanto a nutrientes, osmolaridad y PH, y esto disminuye la viabilidad y capacidad de proliferación de dichas células terapéuticas. Estos resultados fueron obtenidos en cultivo en matrices 2D, tras los que las células son transferidas a animales de laboratorio, y el siguiente paso es su cultivo en matrices tridimensionales para poder ver el comportamiento de dichas células y su posible infiltración dentro de una matriz de este tipo para mejorar su supervivencia.
Otros estudios revelan la capacidad de diferenciación de las NSC (células stem neuronales) bajo determinadas condiciones de microambiente y factores añadidos. El grupo de Fabrizio d'Adda di Fagagna et al. Demuestra la capacidad de diferenciación de estas células madre del cerebro adulto hacia astrocitos observando cómo pierden los marcadores propios de células madre (como son Sox2 y Nestina), y mostrando uno de los marcadores más significativos de células astrocíticas como el GFAP. Demuestran que la exposición de estas células NSC a BrdU (un nucleótido halogenado de baja toxicidad) reduce la expresión de metiltransferasas clave para el DNA y por tanto se pierde la metilación CpG. Además induce la parada de dichas células en fase G0/G1 del ciclo celular.
Además comprueban en células NSC murinas la baja toxicidad por daños en el DNA que este compuesto podría provocar. Esto abre una nueva vía de investigación de posibles células madre cerebrales y su posible inducción para diferenciarse en otros tipos celulares como los astrocitos, que son los principales inductores de la barrera hematoencefálica y la guía y soporte en la migración neuronal.
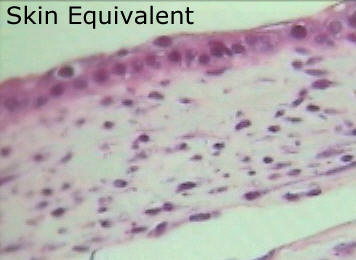
La aplicación más clara y directa, ya en clínicas desde hace algún tiempo son las láminas de equivalentes dérmicos, empleadas en pacientes con quemaduras graves, úlceras varicosas o pie diabético. Estas láminas constan de células mesenquimales cultivadas y derivadas a tipos celulares de la dermis añadiendo determinados factores al cultivo y un gelificante para obtener los equivalentes terapéuticos que se implantarán a modo de curas, y una vez asentadas las células en el microambiente adecuado proseguirán la diferenciación y regenerarán la herida.
Todas estas aplicaciones recientes se apoyan en los protocolos de buenas prácticas de producción (GMPs), se acogen al reglamento de la farmacopea española en su apartado específico y están en fase clínica de uso y seguimiento. Cabe destacar los años de trabajo y dedicación para hacer de esto una terapia cada día más empleada, enfocada a enfermedades que de otro modo serían más difíciles de curar, llevarían más trabajo o serían degenerativa e incurable.
Y recordemos que, como dijo el venerado A. Fleming "Y para el investigador no existe alegría comparable a la de un descubrimiento, por pequeño que sea..."
Immunomodulatory effects of human amniotic membrane-derived mesenchymal stem cells
Jung Won Kang, Hye Cheong Koo, Sun Young Hwang, Sung Keun Kang, Jeong Chan Ra Moon Han Lee, Yong Ho Park*
Departments of Microbiology, and Biochemistry, College of Veterinary Medicine, and BK 21 Program for Veterinary Science, Seoul National University, Seoul 151-742, Korea 3Samsung Advanced Institute of Technology, Samsung Electronics, Yongin 446-712, Korea 4Research Center, RNL Bio, Seoul 153-768, Korea
Responses of human adipose-derived mesenchymal stem cells to chemical microenvironment of the intervertebral disc.
Chengzhen Liang et al.
Journal of Translational Medicine 2012, 10:49 doi:10.1186/1479-5876-10-49.
Neural stem cells exposed to BrdU lose their global DNA methylation and undergo astrocytic differentiation
Leonid Schneider, and Fabrizio d'Adda di Fagagna.
IFOM Foundation, The FIRC Institute of Molecular Oncology Foundation, Via Adamello 16, 20139 Milan and Istituto di Genetica Molecolare, Consiglio Nazionale delle Ricerche (CNR), Via Abbiategrasso 207, 27100 Pavia, Italy
Received December 5, 2011; Revised and Accepted February 15, 2012
Células madre adultas en fase clínica. Ana Sánchez. Universidad de Valladolid.